Estimulación cardiaca permanente en pacientes con bloqueo aurículoventricular
Finn Akerström, Miguel A. Arias, Marta Pachón y Alberto Puchol..
Unidad de Arritmias y Electrofisiología Cardiaca.
Servicio de Cardiología. Hospital Virgen de la Salud
Toledo, España.
Introducción
El bloqueo auriculoventricular (BAV) representa, junto a la enfermedad del nodo sinusal, la indicación de estimulación cardiaca permanente más habitual en la práctica clínica diaria. El presente trabajo pretende revisar las indicaciones de la estimulación permanente en pacientes con BAV, los efectos potencialmente perjudiciales como consecuencia de una estimulación prolongada en ápex del ventrículo derecho (AVD) y las estrategias disponibles para evitarlo.
Indicación de estimulación permanente en pacientes con bloqueo aurículoventricular
En pacientes con BAV de tercer grado y segundo grado tipo Mobitz 2, se recomienda la estimulación permanente mediante marcapasos independientemente de la sintomatología. En el BAV de segundo grado tipo Mobitz 1 (1) puede ser difícil establecer la indicación de marcapasos cuando no se haya demostrado una relación causa-efecto en relación a la sintomatología. No obstante, en caso de sintomatología típica y/o evidencia de origen intra- o infrahisiano (sugerido por complejo QRS ancho o confirmado mediante estudio electrofisiológico) estaría indicado el implante de marcapasos (Tabla 1).(1)

Tabla 1. Recomendaciones para la estimulación permanente en el BAV adquirido, según la Sociedad Europea de Cardiología (2013)
Efectos deletéreos de la estimulación permanente en apex del ventrículo derecho
La estimulación permanente en AVD produce asincronía eléctrica y mecánica inter- e intraventricular, con mayor retraso de activación objetivado en la zona inferoposterobasal del ventrículo izquierdo (VI), similar a lo que sucede con el bloqueo de rama izquierda (BRI). Consecuentemente, se ha informado sobre un empeoramiento de los parámetros hemodinámicos en la fase aguda con reducción de la función sistólica del ventrículo izquierdo (FEVI) y remodelado del ventrículo izquierdo a medio plazo.(2) Asimismo, el estudio DAVID reportó un deterioro clínico a largo plazo en pacientes con FEVI deprimida sometida a estimulación crónica en AVD.(4) Un total de 506 pacientes sin bradiarritmia, en los que se implantó un desfibrilador automático implantable (DAI), fueron aleatorizados a dos modos de estimulación diferentes: DDDR con la frecuencia mínima programada a 70 impulsos por minuto (ipm) y VVI a 40 ipm. La hipótesis del estudio se basaba en que un aumento de la frecuencia cardiaca se asociaría a una mejoría clínica gracias a un mayor gasto cardiaco secundario y una mayor facilidad en la titulación del tratamiento betabloqueante. Al contrario de lo esperado, el estudio fue detenido de forma precoz tras haber objetivado un aumento del objetivo primario compuesto de mortalidad total u hospitalización por IC, en el grupo DDDR-70. En un subanálisis del mismo estudio, se objetivó una relación continua entre el porcentaje de estimulación en AVD y el objetivo primario, obervándose una divergencia significativa a partir de >40% de estimulación ventricular (Figura 1).(5) Los resultados mencionados fueron confirmados en pacientes con el mismo perfil clínico en un subanálisis del estudio MADIT II.(6)
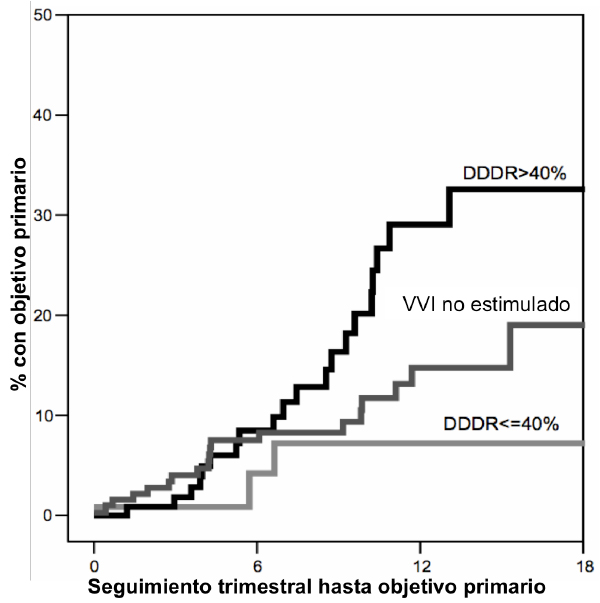
Figura 1. Curvas de Kaplan-Meier del objetivo primario compuesto de mortalidad u hospitalización por insuficiencia cardiaca para los grupos DDDR-70 >40% de estimulación del ventrículo derecho (VD), DDDR-70 <40% de estimulación del VD, y VVI-40, en el estudio DAVID. Tomado de Sharma et al.,5 con permiso.
La información sobre los efectos negativos de la estimulación permanente en AVD en pacientes con FEVI normal está limitada a subanálisis de ensayos clínicos diseñados para comparar la estimulación bicameral (DDD) (o AAI en algunos casos) con monocameral (VVI) en pacientes con disfunción sinusal (DS) y/o BAV.(2) Como ya se ha comentado previamente, en ninguno de los estudios se logró demostrar un beneficio claro de la estimulación bicameral a pesar de promover la sincronía AV. No obstante, los pacientes con estimulación bicameral fueron sometidos a una mayor cantidad de estimulación en AVD, lo cual podría haber neutralizado el beneficio obtenido a través de la preservación de sincronía AV. Además, el estudio MOST que incluyó a 2010 pacientes con DS aleatorizados a estimulación en modo DDDR vs. VVIR demostró, tras un seguimiento medio de 33 meses, un aumento significativo de FA y hospitalización por IC en el grupo DDDR.(7) Una mayor cantidad de estimulación en AVD fue reportado en el grupo DDDR (90% vs. 58% en VVIR), e igual que en los estudios DAVID(5) y MADIT II,(6) una relación positiva entre el porcentaje de estimulación en AVD y el objetivo primario fue establecido en un subanálisis posterior.(8)A pesar de la existencia de datos indirectos que sugieren un efecto negativo de la estimulación permanente en AVD en pacientes con FEVI conservada, no está clara su magnitud y relevancia clínica. No obstante el BAV probablemente conlleva un riesgo mayor, ya que es esperable que se asocie a una mayor cantidad de estimulación que la DS.
Estrategias para minimizar los efectos deletéreos de la estimulación permanente del ventrículo derecho
Optimización de la programación del marcapasos. Existen múltiples algoritmos de marcapasos o DAI que minimizan la estimulación en AVD. Éstos se pueden dividir en los que prolongan el intervalo AV de forma periódica para facilitar la conducción AV intrínseca (histéresis AV), y los que operan en un modo auricular (AAI) primario con la posibilidad de estimulación ventricular a través de cambio al modo DDD en el caso de BAV significativo (Tabla 2). El algoritmo más estudiado es el Managed Ventricular Pacing™ (MVP) (Medtronic, Minneapolis, MN, EEUU), que pasa de modo AAI al DDD en el caso de BAV en dos de cuatro latidos consecutivos (Figura 2).

Figura 2. Ejemplo de paciente con el algoritmo Managed Ventricular Pacing (Medtronic, Minneapolis, MN, EEUU) A: Modo primario AAI(R). B: Bloqueo aurículoventricular (BAV) (indicado con círculos discontinuos) es definido como la ausencia de un evento ventricular sensado entre dos eventos auriculares. La estimulación ventricular “backup” (marcado con un *) se produce a los 80ms de producirse el Ejemplo de paciente con el algoritmo Managed Ventricular Pacing (Medtronic, Minneapolis, MN, EEUU) A: Modo primario AAI(R). B: Bloqueo aurículoventricular (BAV) (indicado con círculos discontinuos) es definido como la ausencia de un evento ventricular sensado entre dos eventos auriculares. La estimulación ventricular “backup” (marcado con un *) se produce a los 80ms de producirse el BAV. C: BAV en 2 de 4 intervalos A-A consecutivos, produce cambio al modo DDD(R).
Es más efectivo en reducir la cantidad de estimulación ventricular que los algoritmos de histéresis AV, tanto en pacientes con DS como en BAV de primer, segundo y tercer grado intermitente.(9) Es importante señalar que, aunque existan datos a favor de un beneficio clínico (reducción de riesgo de FA persistente) con el MVP en pacientes con DS,(10) no hay estudios que lo hayan mostrado en pacientes con BAV. Además, no se recomienda el MVP en pacientes con BAV de primer grado significativo (intervalo PR >230ms), dado que el algoritmo permite el desacoplamiento AV con efectos hemodinámicos y clínicos potencialmente negativos.(11) Igual que el MVP, existen otros algoritmos menos conocidos y estudiados que operan en modo auricular (AAI) primario con cambio al modo DDD en presencia de BAV significativo como AAISafeR2™ (Sorin Group, Mirandola, Italy) y RMS/RYTHMIQ™ (Boston Scientific, St. Paul, MN, EEUU) (Ver Tabla 2) aunque este último podría ser problemático en pacientes con extrasistolia ventricular frecuente.(12) Por último, cabe mencionar que ante un BAV infrecuente y paroxístico, la estimulación en modo VVI con una frecuencia mínima de 40 ipm, podría ser una manera sencilla y efectiva de evitar la estimulación innecesaria en AVD en subgrupos seleccionados de pacientes.
Terapia de resincronización cardiaca
La terapia de resincronización cardiaca (TRC) reduce la morbimortalidad en pacientes con IC sintomática, BRI y FEVI severamente deprimida.(1) Asimismo, recientemente se ha demostrado que los pacientes con FEVI deprimida, y un alto porcentaje de estimulación en AVD sin indicación convencional de TRC, también se pueden beneficiar de dicha terapia. En el estudio BLOCK-HF, un estudio aleatorizado, prospectivo y multicéntrico publicado recientemente, se comparó la TRC con la estimulación convencional en AVD en 691 pacientes con FEVI deprimida (≤50%) e indicación de estimulación permanente por BAV.(13) La mayoría de los pacientes se encontraban en clase funcional I-II de la New York Heart Association (NYHA), la FEVI media era de 40±8% y la proporción de BAV de primer, segundo y tercer grado fue de 19%, 33% y 48% respectivamente. No se emplearon los algoritmos de minimización de estimulación ventricular, por lo que el porcentaje de estimulación en AVD fue muy alto (98.6%). Tras un seguimiento medio de 37 meses, hubo una disminución significativa de un 26% del riesgo relativo del objetivo primario a favor de la TRC, siendo tal objetivo primario un compuesto del tiempo hasta la muerte por cualquier causa, descompensación de IC o un incremento mayor del 15% en índice del volumen telesistólico de VI. En pacientes con indicación de estimulación permanente por BAV con FEVI conservada, no existe evidencia sólida de que la TRC ofrezca un beneficio clínico en el momento actual.
La actualización o “upgrade” a TRC, se debería considerar en el paciente con FEVI deprimida portador de DAI o marcapasos convencional, que recibe una alta cantidad de estimulación en AVD. A pesar de la ausencia de grandes ensayos clínicos, los resultados de varios estudios observacionales sugieren que el “upgrade” a TRC en pacientes con FEVI deprimida e IC sintomática, se asocia a una mejora del remodelado cardiaco inverso y de la sintomatología, semejante al observado en pacientes sometidos a primoimplantes.(14) Además, recientemente un pequeño estudio aleatorizado en pacientes con FEVI deprimida y ninguna o escasa sintomatología de IC, demostró una mejoría de la FEVI, capacidad de ejercicio y calidad de vida a los 6 meses, en el grupo de “upgrade” a TRC frente al grupo de marcapasos convencional.(15) No obstante, hay que poner en la balanza el beneficio potencial del “upgrade” a TRC, y el riesgo significativo de complicaciones adicionales asociados a la implantación de un cable en el sistema venoso coronario, que en el estudio BLOCK-HF ocurrieron en el 6,4% de los pacientes.
Estimulación no-apical del ventrículo derecho
La estimulación no-apical del ventrículo derecho (VD) pretende reducir los efectos negativos de la estimulación en AVD, mediante la estimulación en un punto más próximo al sistema nativo de conducción, habitualemente el tracto de salida del VD o el septo interventricular (figura 3). Algunos estudios han demostrado una reducción de asincronía, mejoría de FEVI y remodelado inverso con la estimulación no-apical en VD, siendo los pacientes con FEVI deprimida los más beneficiados.(16) Aun así, no se ha demostrado una mejoría clínica de la estimulación no-apical del VD derivada de datos de estudio multicéntricos, prospectivos y aleatorizados.

Figura 3. Imágenes fluoroscópicas en las proyecciones oblicua anterior derecha e izquierda de un electrodo ventricular de estimulación posicionado en una zona medio-septal. Tomado de Cano et al. Am J Cardiol 2010, con permiso.
Qué dicen las guías de práctica clínica?
Para disminuir los efectos negativos de la estimulación crónica en AVD, y en base a los resultados del estudio BLOCK-HF,(13) las guías europeas de práctica clínica del año 2013 recomiendan la TRC a los pacientes con FEVI deprimida (≤50%) e indicación concomitante de marcapasos convencional, cuando se prevea un porcentaje elevado de estimulación en AVD(1). No se hace referencia a partir de qué porcentaje se debería considerar una alta cantidad de estimulación en AVD, aunque >40-50% parece un número razonable según la información disponible de los subanálisis de DAVID(5) y MADIT II(6). Como es probable que un paciente con BAV precise una alta cantidad de estimulación en AVD, se debería considerar la TRC en todo paciente con FEVI deprimida e indicación de marcapasos convencional por BAV. Las mismas guías de práctica clínica no hacen recomendaciones acerca del uso de algoritmos para minimizar la estimulación en AVD o la estimulación no-apical del VD ya que en la actualidad no se dispone de evidencia que apoye un beneficio clínico en pacientes con BAV.
Conclusión
En el paciente con indicación de estimulación permanente mediante marcapasos por BAV, se recomienda la estimulación bicameral (DDD) como primera opción en pacientes jóvenes y físicamente activos, aunque el nivel de evidencia es baja por falta de grandes estudios prospectivos y aleatorizados en este grupo de pacientes. Para pacientes con FA permanente, se debería implantar un sistema monocameral con la respuesta en frecuencia activada (VVIR). En la edad avanzada con movilidad muy limitada, se podría considerar un sistema monocameral (VVI). Hay evidencia de que una alta cantidad (>40-50%) de estimulación permanente en AVD produce asincronía eléctrica y mecánica ventricular, deterioro hemodinámico y, en pacientes con FEVI deprimida, mayor morbimortalidad a largo plazo. La TRC puede reducir los efectos negativos de la estimulación permanente en AVD en pacientes con BAV y FEVI deprimida, y se debería considerar en este perfil de pacientes. Cuando la FEVI está conservada y existe indicación de marcapasos convencional por BAV, es importante una correcta programación del dispositivo, considerando los algoritmos que minimizan la estimulación ventricular en los casos de BAV de segundo y tercer grado intermitente.
NOTA: Los resultados de los casos de estudio no son necesariamente predictivos de los resultados en otros casos. Los resultados en otros casos pueden variar.
Bibliografía
1 Authors/Task Force M, Brignole M, Auricchio A, Baron-Esquivias G, Bordachar P, Boriani G, Breithardt OA, Cleland J, Deharo JC, Delgado V, Elliott PM, Gorenek B, Israel CW, Leclercq C, Linde C, Mont L, Padeletti L, Sutton R, Vardas PE, Guidelines ESCCfP, Zamorano JL, Achenbach S, Baumgartner H, Bax JJ, Bueno H, Dean V, Deaton C, Erol C, Fagard R, Ferrari R, Hasdai D, Hoes AW, Kirchhof P, Knuuti J, Kolh P, Lancellotti P, Linhart A, Nihoyannopoulos P, Piepoli MF, Ponikowski P, Sirnes PA, Tamargo JL, Tendera M, Torbicki A, Wijns W, Windecker S, Document R, Blomstrom-Lundqvist C, Badano LP, Aliyev F, Bansch D, Bsata W, Buser P, Charron P, Daubert JC, Dobreanu D, Faerestrand S, Le Heuzey JY, Mavrakis H, McDonagh T, Merino JL, Nawar MM, Nielsen JC, Pieske B, Poposka L, Ruschitzka F, Van Gelder IC, Wilson CM. 2013 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy: The Task Force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). Eur Heart J 2013;34:2281-2329.
2 Akerstrom F, Pachon M, Puchol A, Jimenez-Lopez J, Segovia D, Rodriguez-Padial L, Arias MA. Chronic right ventricular apical pacing: Adverse effects and current therapeutic strategies to minimize them. International Journal of Cardiology 2014. http://dx.doi.org/10.1016/IntJCardiol2014;173:351-360.
3 Gillis AM, Russo AM, Ellenbogen KA, Swerdlow CD, Olshansky B, Al-Khatib SM, Beshai JF, McComb JM, Nielsen JC, Philpott JM, Shen WK, Heart Rhythm S, American College of Cardiology F. HRS/ACCF expert consensus statement on pacemaker device and mode selection. Developed in partnership between the Heart Rhythm Society (HRS) and the American College of Cardiology Foundation (ACCF) and in collaboration with the Society of Thoracic Surgeons. Heart Rhythm 2012;9:1344-1365.
4 Wilkoff BL, Cook JR, Epstein AE, Greene HL, Hallstrom AP, Hsia H, Kutalek SP, Sharma A, Dual C, Investigators VVIIDT. Dual-chamber pacing or ventricular backup pacing in patients with an implantable defibrillator: the Dual Chamber and VVI Implantable Defibrillator (DAVID) Trial. JAMA 2002;288:3115-3123.
5 Sharma AD, Rizo-Patron C, Hallstrom AP, O’Neill GP, Rothbart S, Martins JB, Roelke M, Steinberg JS, Greene HL, Investigators D. Percent right ventricular pacing predicts outcomes in the DAVID trial. Heart Rhythm 2005;2:830-834.
6 Steinberg JS, Fischer A, Wang P, Schuger C, Daubert J, McNitt S, Andrews M, Brown M, Hall WJ, Zareba W, Moss AJ, Investigators MI. The clinical implications of cumulative right ventricular pacing in the multicenter automatic defibrillator trial II. J Cardiovasc Electrophysiol 2005; 16:359-365.
7 Lamas GA, Lee KL, Sweeney MO, Silverman R, Leon A, Yee R, Marinchak RA, Flaker G, Schron E, Orav EJ, Hellkamp AS, Greer S, McAnulty J, Ellenbogen K, Ehlert F, Freedman RA, Estes NA, 3rd, Greenspon A, Goldman L, Mode Selection Trial in Sinus-Node D. Ventricular pacing or dual-chamber pacing for sinus-node dysfunction. N Engl J Med 2002;346:1854-1862.
8 Sweeney MO, Hellkamp AS, Ellenbogen KA, Greenspon AJ, Freedman RA, Lee KL, Lamas GA, Investigators MOST. Adverse effect of ventricular pacing on heart failure and atrial fibrillation among patients with normal baseline QRS duration in a clinical trial of pacemaker therapy for sinus node dysfunction. Circulation 2003;107:2932-2937.
9 Murakami Y, Tsuboi N, Inden Y, Yoshida Y, Murohara T, Ihara Z, Takami M. Difference in percentage of ventricular pacing between two algorithms for minimizing ventricular pacing: results of the IDEAL RVP (Identify the Best Algorithm for Reducing Unnecessary Right Ventricular Pacing) study. Europace 2010;12:96-102.
10 Sweeney MO, Bank AJ, Nsah E, Koullick M, Zeng QC, Hettrick D, Sheldon T, Lamas GA, Search AVE, Managed Ventricular Pacing for Promoting Atrioventricular Conduction T. Minimizing ventricular pacing to reduce atrial fibrillation in sinus-node disease. N Engl J Med 2007;357:1000-1008.
11 Sweeney MO, Ellenbogen KA, Tang AS, Whellan D, Mortensen PT, Giraldi F, Sandler DA, Sherfesee L, Sheldon T, Managed Ventricular Pacing Versus VVIPTI. Atrial pacing or ventricular backup-only pacing in implantable cardioverter-defibrillator patients. Heart Rhythm 2010;7:1552-1560.
12 Akerstrom F, Arias MA, Pachon M, Puchol A, Jimenez-Lopez J, Rodriguez-Padial L. The Reverse Mode Switch Algorithm: How Well Does It Work? Heart Rhythm 2013:1146-1152.
13 Curtis AB, Worley SJ, Adamson PB, Chung ES, Niazi I, Sherfesee L, Shinn T, Sutton MS, Biventricular versus Right Ventricular Pacing in Heart Failure Patients with Atrioventricular Block Trial I. Biventricular pacing for atrioventricular block and systolic dysfunction. N Engl J Med 2013;368:1585-1593.
14 SFrohlich G, Steffel J, Hurlimann D, Enseleit F, Luscher TF, Ruschitzka F, Abraham WT, Holzmeister J. Upgrading to resynchronization therapy after chronic right ventricular pacing improves left ventricular remodelling. Eur Heart J 2010;31:1477-1485.
15 Gierula J, Cubbon RM, Jamil HA, Byrom R, Baxter PD, Pavitt S, Gilthorpe MS, Hewison J, Kearney MT, Witte KK. Cardiac resynchronization therapy in pacemaker-dependent patients with left ventricular dysfunction. Europace 2013;15:1609-1614.
16 Shimony A, Eisenberg MJ, Filion KB, Amit G. Beneficial effects of right ventricular non-apical vs. apical pacing: a systematic review and meta-analysis of randomized-controlled trials. Europace 2012;14:81-91.




