Programación de los dispositivos de terapia de resincronización cardiaca
Por Roberto Matía, Antonio Hernández-Madrid, Eduardo Franco, Daniel Rodríguez, José Luis Zamorano y Javier Moreno.
Unidad de Arritmias. Servicio de cardiología. Hospital Ramón y Cajal.
Introducción
A pesar de los importantes avances conseguidos en cuanto a la técnica y experiencia en el implante de los dispositivos de terapia de resincronización cardiaca (TRC), continúa habiendo un porcentaje de entre un 30-40% de pacientes que no obtienen el beneficio que pretendemos con la terapia. Las estrategias para tratar de incrementar el porcentaje de respondedores son un área de investigación actual. Las principales líneas de investigación se centran en la selección de candidatos y las estrategias de programación adecuada de los dispositivos. El objetivo de este trabajo es revisar las áreas de mayor interés actual en materia de programación, en particular los algoritmos de programación automática de los intervalos de estimulación, la programación de la estimulación con los electrodos cuatripolares y la estimulación multipunto, así como describir el funcionamiento y los resultados clínicos preliminares con el empleo de un nuevo algoritmo automático que permite determinar el porcentaje de captura efectiva de ventrículo izquierdo (VI).
Métodos de programación de los intervalos de estimulación AV y VV
Numerosos trabajos no aleatorizados han sugerido un beneficio de la programación de los intervalos de estimulación basada en diferentes métodos (figura 1).
Aunque sabemos que una programación inadecuada puede limitar el beneficio de la TRC1, los estudios randomizados no han demostrado de manera concluyente aumentar el porcentaje de pacientes respondedores, habiéndose obtenido únicamente resultados positivos en determinados subgupos de pacientes (tabla 1). Varios factores han podido contribuir a ello. En relación con los métodos basados en tiempos de activación eléctrica, se han demostrado discrepancias entre el momento de activación eléctrica de un territorio miocárdico y su contracción mecánica efectiva. Esta “discordancia electro-mecánica” puede justificar en parte la ausencia de beneficio de los algoritmos automáticos basadas en los tiempos de conducción eléctrica2. Los métodos ecocardiográficos de programación han demostrado una baja reproducibilidad. Además los intervalos AV y VV óptimos varían con el tiempo durante el proceso de remodelado eléctrico y mecánico que se producen3. La mayoría de los métodos de optimización evaluados se realizan en reposos y sabemos que las diferentes condiciones hemodinámica y en la velocidad de conducción eléctrica cardiaca que se producen durante el esfuerzo cambian los intervalos de estimulación óptimos en un porcentaje significativo de pacientes4;5. Por último todos estos trabajos se han realizado antes de la implementación de herramientas automáticas que de manera fiable nos permiten evaluar la captura efectiva de ventrículo izquierdo, la cual puede ser significativamente distinta del porcentaje de estimulación biventricular en una importante proporción de casos, como ha sido observado en el recientemente publicado estudio OLE-CRT6.

Tabla 1. Resumen de los ensayos clínicos aleatorizados realizados en materia de optimización de los intervalos de estimulación
Los sistemas que parecen más prometedores son aquellos que utilizan parámetros hemodinámicos para la programación y los que producen una optimización automática frecuente. En este sentido la tecnología SonR, desarrollada por Sorin Group, se basa en la detección de las vibraciones generadas durante la fase de contracción isovolumétrica del VI por un acelerómetro situado en la punta de un cable unipolar que se implanta en la aurícula derecha. Estas vibraciones son, en su componente audible, responsables del primer ruido cardíaco. La aceleración pico de estas vibraciones, Peak Endocardial Aceleration (PEA), ha demostrado una buen correlación con parámetros de contractilidad como la dP/dt7. El área bajo la curva de PEAs se emplea para la optimización, habiéndose demostrado buena correlación con la optimización del intervalo AV guiada por la dP/dt8. El algoritmo realiza una programación semanal de los intervalos de estimulación AV y VV y abre una ventana para detectar si el paciente hace ejercicio y realizar también una optimización durante el esfuerzo. El estudio piloto CLEAR aleatorizó a 268 pacientes a programación de los intervalos de estimulación AV y VV mediante la primera generación del método SonR o a la programación habitual de cada centro. El objetivo primario fue evaluar el porcentaje de pacientes que mejoró clínicamente al cabo de 1 año, basado en un criterio clínico compuesto de mortalidad por cualquier causa, hospitalizaciones para tratamiento de insuficiencia cardiaca, clase funcional de la NYHA y test de calidad de vida9. La aplicación del algoritmo automático incrementó el porcentaje de pacientes respondedores (76% vs 62%, p=0,028). El estudio RESPOND-CRT10 randomizó a 998 pacientes a programación automática con la tecnología SonR vs ecocardiográfica. Se trata de un estudio multicéntrico, prospectivo, de no inferioridad que incluyó pacientes de 125 centros de 12 países en tres continentes. A los 12 meses de seguimiento los pacientes aleatorizados a la optimización automática por el dispositivo fueron respondedores en un 75% de los casos en virtud del mismo objetivo clínico combinado empleado en el ensayo CLEAR, en comparación con el 70,4% de los pacientes en los que se realizó una programación basada en parámetros ecocardiográficos (p< 0,001 para no inferioridad, p=0,13 para superioridad). Los pacientes en el brazo de optimización automática presentaron una reducción del 35% en las hospitalizaciones por insuficiencia cardiaca (HR=0,65, 95% IC: 0,46-0,92; p=0,01). Los pacientes con antecedentes de fibrilación auricular (FA) o insuficiencia renal presentaron un incremento significativo en la tasa de respuesta a la terapia (22 y 16% respectivamente).
El algoritmo AdaptvCRT de Medtronic ofrece una programación automática actualizada cada minuto del intervalo de estimulación AV. Monitoriza el intervalo AV y en los casos con AV normal (AV detectado ≤ 200/220 ms. y estimulado ≤ 250/270 ms., según los dispositivos) ajusta el intervalo AV, estimulando únicamente en VI con un AV igual al 70% del detectado y siempre al menos 40 ms. antes de la detección ventricular derecha (VD), con objeto de conseguir un latido de fusión entre la activación ventricular intrínseca y la estimulación ventricular izquierda. El estudio Adaptive-CRT mostró no inferioridad del algoritmo respecto a la optimización ecocardiográfica11. La incidencia de FA fue menor en los pacientes en los que se empleó el algoritmo automático (16,2 vs 8,8; HR 0,54 IC al 95%: 0,31-0,93; p=0,03). En el brazo AdaptivCRT, los pacientes con AV normal que fueron estimulados únicamente desde VI tuvieron menor incidencia de un objetivo compuesto de hospitalizaciones/mortalidad12. Además la estimulación ventricular derecha se redujo un 44% en el brazo aleatorizado al algoritmo, con el consiguiente ahorro de batería.
En cuanto a los métodos no automáticos mencionar la investigación que se está realizando en programación basada en vectocardiografía (VCG) como alternativa a los basados en el electrocardiograma de superficie o los parámetros ecocardiográficos. La VCG contiene información de las fuerzas eléctricas dentro del corazón y así puede proporcionar una descripción del grado de resincronización cardiaca. Se puede emplear para programar los intervalos AV y VV para obtener el área del vector QRS más pequeña, lo cual expresaría el mayor grado de oposición de fuerzas eléctricas de activación ventricular. Van Deursen C.J. tras demostrar en un modelo canino que la VCG refleja la desincronía eléctrica interventricular y que es una herramienta fiable y reproducible para la optimización de los intervalos de estimulación13, observa en una cohorte de 38 pacientes en TRC que el área vectorial QRS más pequeña identificaba los intervalos de estimulación con los que se obtuvo una mayor respuesta hemodinámica a los 3 meses14. Los autores destacan la alta reproducibilidad del método en comparación con el uso de parámetros ecocardiográficos. La verdadera utilidad clínica del este método requiere futuras investigaciones.
Estimulación con electrodos cuatripolares
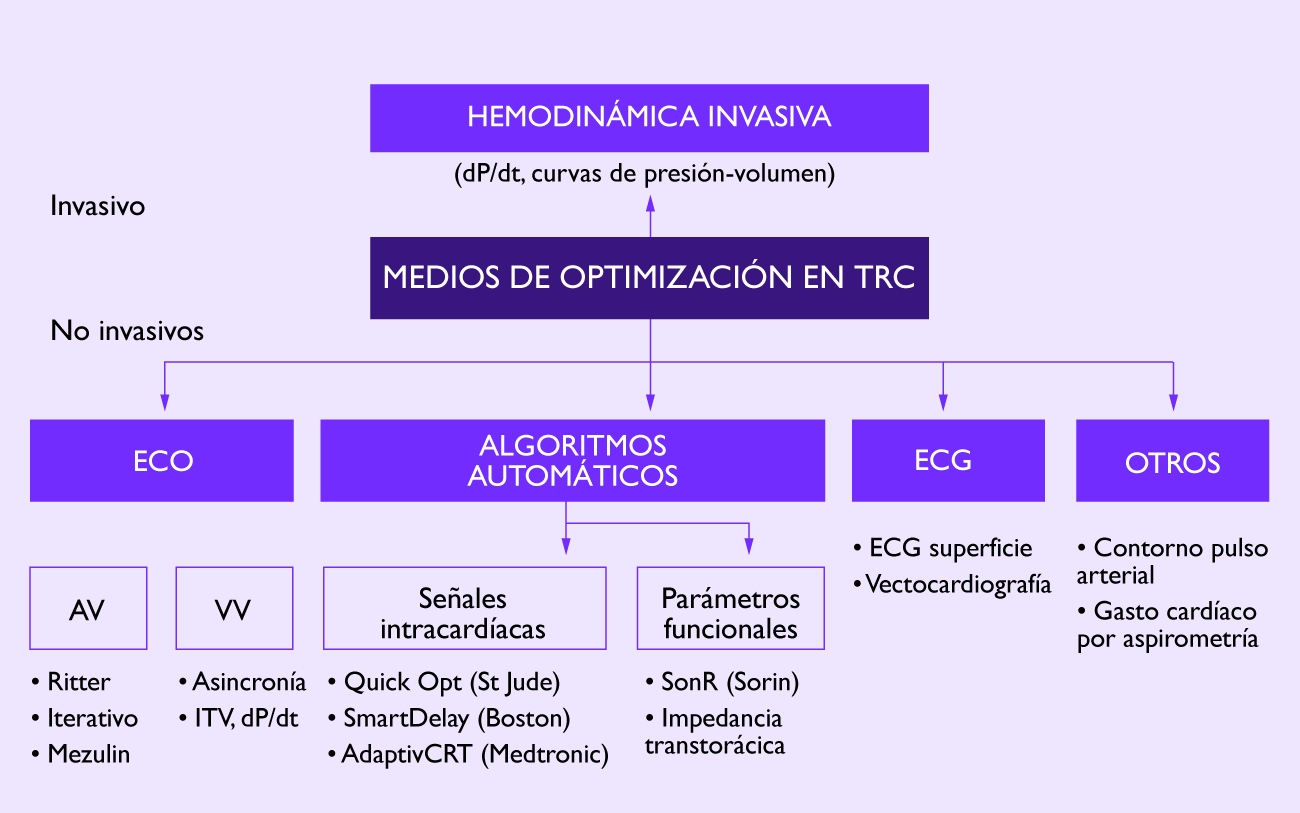
Disponer de diferentes vectores de estimulación de VI es útil para evitar la estimulación frénica y seleccionar las posiciones con adecuados umbrales de estimulación. Además el punto de estimulación que seleccionemos puede influir en el comportamiento hemodinámico agudo tras el implante y podría tener importancia en la respuesta a la terapia15. En un estudio sobre 51 pacientes, Cabrera y cols. observaron un mejor gasto cardiaco determinado por eco desde sitios no tradicionales (definidos como aquellos que no implicaban la estimulación desde los dos electrodos más distales) en un 53% de los casos16. En la figura 2 se recoge un ejemplo de optimización ecocardiográfica del sitio de estimulación con un electrodo cuatripolar. La importancia del lugar de estimulación ha quedado puesta de manifiesto en un subanálisis del estudio MADIT-CRT que mostró un peor pronóstico al estimular desde posiciones apicales17. Las guías de práctica clínica recogen el beneficio probable de evitar la estimulación apical18.

Figura 2: Ejemplo de optimización ecocardiográfica de la estimulación ventricular izquierda con un electrodo cuatripolar. Se observa un importante incremento de la ITV (integral velocidad-tiempo) y de la FEVI (fracción de eyección del ventrículo izquierdo) al estimular en una posición más basal comparada con la estimulación apical.
Por otro lado la estimulación en el sitio de activación más tardío ha mostrado en estudios observacionales estar asociado a una mejora en los resultados de la terapia19-21. En la serie de 301 casos de D’Onofrio et.al., los pacientes con un intervalo entre los electrogramas registrados desde VD e izquierdo mayor de 80 ms. presentaron mejor respuesta a la terapia definida por una disminución >15% del volumen telediastólico de VI. En todos los casos el electrodo de VD se situó en el ápex19. Zanon y cols. demuestran en 32 pacientes consecutivos que en el 97% de sus casos la mayor dP/dt invasiva se obtuvo al estimular desde posiciones en las que se observó un mayor intervalo Q-LV, definido como el tiempo desde el inicio del QRS en el ECG de superficie a la primera deflexión positiva o negativa amplia en la señal bipolar del VI. Un intervalo >95 ms. se asoció a un incremento en la dP/dt máxima ≥ 10%22.
Algunos dispositivos disponen de herramientas que miden automáticamente los tiempos de conducción a los distintos electrodos de VI durante estimulación o detección de VD, como por ejemplo el Vector ExpressTM de Medtronic o VectSelect QuartetTM de St Jude o LV VectorGuideTM de Boston, y nos pueden ayudar a seleccionar la estimulación desde aquellas localizaciones de VI que presenten una actividad eléctrica más tardía.
Actualmente disponen de cables cuatripolares Medtronic, St Jude Medical, Boston Scientific y Biotronik. Los electrodos cuatripolares de Medtronic tienen una distancia de 1,3 mm entre los electrodos 2 y 3 para reducir la estimulación frénica23. Los generadores con conexión para los electrodos cuatripolares de esta compañía son únicamente DAIs en la actualidad. Próximamente (ya obtenida la marca CE) dispondremos de la familia de marcapasos CRT-P Percepta con conexión a electrodo cuatripolar. Entre los 4 electrodos de VI podemos configurar 12 vectores de estimulación bipolar y 4 en configuración pseudobipolar con la bobina de ventrículo derecho. Los generadores de St Jude permite configurar 10 vectores de estimulación (6 en configuración bipolar verdadera, teniendo en cuenta que el electrodo impar no puede ser el ánodo) y 4 en pseudobipolar con la bobina de ventrículo derecho en los generadores de DAI. A ello se suman otras 4 configuraciones en monopolar en los generadores CRT-P.
Perspectivas futuras. Estimulación multipunto y valoración automática de la captura efectiva del ventrículo izquierdo
A. Estimulación multipunto
La estimulación multipunto consigue la preactivación de un mayor volumen de miocardio ventricular izquierdo mediante la captura desde dos puntos de estimulación con el empleo de electrodos multiplores. En los últimos años se han realizado varios estudios que han demostrado el beneficio hemodinámico agudo y en parámetros de sincronía, remodelado y función ventricular a corto y medio plazo de la estimulación ventricular izquierda multipunto24-29. En un estudio observacional retrospectivo de 110 pacientes en TRC, Zanon y cols. definen tres cohortes; uno grupo estándar, otro en el que se realiza optimización del lugar de estimulación en base al mayor intervalo Q-LV y el incremento máximo de la dP/dt obtenida de manera invasiva y un tercero con optimización junto con estimulación multipunto. En un seguimiento a un año observan una mejor respuesta ecocardiográfica, definida como una reducción del volumen telediastólico de ventrículo izquierdo ≥15%, en el grupo de estimulación multipunto (90% vs 72,2% vs 55,6%, p=0,0015). Las variables de respuesta clínica analizadas también fueron significativamente mejores en el grupo de estimulación multipunto22. En el registro IRON-MPP fueron incluidos 232 pacientes en 76 centros en Italia con un seguimiento a 6 meses. En 94 casos se programó la estimulación multipunto al alta del implante. Estos pacientes presentaron una mayor tasa de respuesta ecocardiográfica definida por un incremento en la FEVI ≥5% (74% vs 58%, p=0,012). La activación de la estimulación multipunto fue un factor independiente asociado a mejoría de la FEVI (odds ratio 2,5; p=0,001). También presentaron un mayor porcentaje de respuesta clínica en virtud de un objetivo clínico compuesto (56 vs 385, p=0,009)30.
Son necesarios estudios aleatorizados para conocer si la estimulación multipunto demostrará aumentar la tasa de respondedores a medio y largo plazo y para contestar a la pregunta de si debemos iniciarla tras el implante de manera rutinaria o solo en los pacientes que en el seguimiento sean no respondedores. Para ello se están realizando en la actualidad dos estudios prospectivos, randomizados, multicéntricos, doble ciego. The MultiPoint Pacing IDE Study (NCT01786993), realizado en Estados Unidos, incluirá a 506 pacientes que serán aleatorizados a implante de un sistema de resincronización convencional o con electrodo cuatripolar para estimulación multipunto. El objetivo primario es la respuesta a los 9 meses y la tasa de complicaciones. El estudio MOre REsponse on Cardiac Resynchronization Therapy With MultiPoint Pacing (MORE-CRT MPP) (NCT02006069) está siendo realizado en Europa, Canadá y otros centros no USA. La randomización se realiza a los 6 meses del implante a TRC convencional o multipunto en los pacientes no respondedores, definidos como aquellos que no presentan una reducción del volumen telesistólico ≥15%. El objetivo principal es evaluar el porcentaje de pacientes convertidos en respondedores a 6 meses de seguimiento.
St Jude, Medtronic, Boston y Biotronik disponen en la actualidad de generadores de DAI-CRT capaces de estimulación multipunto mediante electrodos de estimulación cuatripolar. Los generadores de marcapasos-CRT de St Jude Allure Quadra MPP también pueden realizar estimulación multipunto de VI. Próximamente dispondremos de los generadores de marcapasos CRT-P Percepta de Medtronic con capacidad de estimulación multipunto. Las diferencias entre los dos sistemas con generadores CRT-P y CRT-D disponibles se exponen en la figura 3.

Figura 3. Diferencias en el funcionamiento de los dos sistemas de estimulación multipunto con generadores CRT-P y CRT-D disponibles actualmente.
En los dispositivos de St Jude hemos de tener en cuenta en cuanto a la programabilidad que la estimulación multipunto es posible únicamente con frecuencias básicas ≤ 110 lpm. Además varios impulsos cercanos entre sí tienen la capacidad de generar un desequilibrio en la carga alrededor del electrodo por lo que para amplitudes de estimulación >5V los intervalos entre los distintos puntos de estimulación ventricular han de ser ≥ 10 ms. y para anchuras >0.5 ms. han de ser ≥15 ms. El modo trigger funciona con intervalos fijos de 5 ms. por lo que las amplitudes y anchuras de impulso de VD y VI no pueden ser mayores a 5.0 V y 0.5 ms. respectivamente. Para poder programar la autocaptura (RVCap Confirm/LVCap Confirm) los dos intervalos de estimulación ventricular han de ser ≥15 ms. Por todo ello el modo trigger y la autocaptura no pueden activarse juntos. Se estima que la estimulación multipunto disminuye la longevidad de la batería entre 1 y 1,2 años de media.
Los familia de generadores CRT-D Resonate de Boston (Resonate X4, CharsimaX4 y Vigilant X4) disponen de 216 vectores de estimulación multisitio (es posible estimular en monopolar) con cátodos independientes y programabilidad de intervalos de estimulación ventricular entre 0 y 100 ms. Podemos programar una estimulación biventricular o únicamente desde VI, habiéndose estimado una duración de la batería de hasta 13,3 años en esta última.
Los generadores Biotronik Intica 5/7 ofrecen hasta 106 vectores de estimulación multipunto con cátodos independientes e intervalos de estimulación ventricular entre 0-50 ms. y una configuración de estimulación únicamente biventricular.
En cuanto al mejor modo de programar la estimulación, un estudio realizado por Pappone y cols. mediante optimización hemodinámica invasiva muestra que en el 71% de los pacientes la mejor configuración de estimulación era aquella en la que se estimulaba con los electrodos de VI con la mayor separación anatómica, en comparación con el 21% de los casos en los que lo mejor fue estimular con los que presentaban mayor diferencia de activación eléctrica durante estimulación de VD. La estimulación lo más sincrónica posible, con el mínimo retraso de estimulación que ofrecen los dispositivos de St Jude que es de 5 ms., produjo resultados más favorables que incrementar el intervalo entre los dos puntos de estimulación izquierda26. Estos resultados favorecen la programación empírica basada en la máxima separación anatómica del cátodo y mínimos retrasos de estimulación.
B. Captura efectiva del ventrículo izquierdo
El documento de consenso de la EHRA/HRS sobre la CRT de 2012 recoge textualmente que “la respuesta clínica a la CRT depende de porcentaje de captura biventricular efectiva durante la actividad diaria, y eso no puede asegurarse revisando sólo un ECG en reposo. El porcentaje de estimulación biventricular almacenado por el dispositivo puede no ser real, la presencia de estímulo no implica captura”31. Además según las guías de estimulación cardiaca y terapia de resincronización cardiaca la Sociedad Europea de Cardiología de 2013 “el análisis del ECG de superficie es obligatorio en algunos casos así como el grabación de un Holter para evaluar la captura biventricular completa y excluir la pseudofusión, que para el dispositivo se registrará como latido estimulado”18.
La compañía Medtronic ha desarrollado un sistema de valoración latido a latido de la captura ventricular izquierda efectiva que se basa en el análisis del electrograma entre la punta del electrodo de VI y la bobina de VD. Cuando la captura ventricular izquierda es efectiva genera una deflexión negativa inicial en el EGM (morfología QS o QS-r)32. El diagnóstico EffectivCRT™ analiza 100 latidos cada hora y ofrece un recuento del porcentaje de captura ventricular izquierda efectiva respecto del total de estimulación ventricular. Este algoritmo está implementado en los dispositivos DAI-CRT Medtronic Claria CRT y también lo estará en los nuevos generadores de marcapasos CRT-P Medtronic Percepta. Estos dispositivos cuentan además con un algoritmo que automáticamente incrementa ligeramente la frecuencia mínima de estimulación para aumentar el porcentaje de estimulación izquierda efectiva durante FA.
El estudio OLÉ CRT6, es un estudio de evaluación en 51 pacientes de la utilidad clínica de este método de cuantificación de la captura ventricular izquierda efectiva. En esta cohorte de pacientes, el porcentaje de estimulación media (94,8 ± 8%) fue significativamente mayor que el porcentaje de captura efectiva de VI (87,5 ± 23%, p <0,001). De 57 pacientes, 17 (29%) presentaron menos de un 90% de estimulación eficaz del VI. Un 18% de los pacientes presentaron una diferencia mayor del 3% entre el porcentaje de estimulación efectiva y el de estimulación total con una media del 39 ± 41%. Las causas de la estimulación ineficaz fueron extrasistolia ventricular, fibrilación auricular (FA), fenómeno de latencia eléctrica, pérdida intermitente de captura y conducción nodal variable (figura 4). La más frecuente de ellas fue la FA. Mención especial merece el caso de los tres pacientes que presentaban fenómeno de latencia eléctrica en los cuales el porcentaje de estimulación ventricular izquierda efectiva fue particularmente bajo (máxima del 7%)6. En ellos puede ser necesario preactivar hasta 80 ms. el VI para poder obtener una captura ventricular izquierda efectiva33.

Figura 4. Se muestra el electrograma punta VI—bobina VD y el canal de marcas durante dos registros que presentan latidos con estimulación ventricular izquierda inefectiva; en el panel A debido a pérdida de captura intermitente y en B a pseudofusiones durante fibrilación auricular. Los latidos con captura ventricular efectiva muestran q incial y los latidos con estimulación
Qué dicen las guías sobre la programación de los dispositivos de TRC?
Las guías de 2013 de la Sociedad Europea de Cardiología sobre marcapasos y resincronización cardiaca asignan un beneficio adicional escaso o incierto a los métodos de programación de los intervalos de estimulación basados en parámetros ecocardiográficos, electrocardiográficos o en los algoritmos automáticos de los dispositivos, en comparación con una programación empírica de un intervalo AV detectado de unos 120 ms. (entre 100-120 ms.) y una estimulación biventricular sincrónica18. Estas recomendaciones fueron realizadas antes de la publicación de los estudio Adaptive-CRT10;12 y Respond10 en base a la ausencia de beneficio clínico o en parámetros de remodelada en los estudios randomizados y metaanálisis34 realizados hasta esa fecha en materia de programación de los intervalos de estimulación. Nos dicen que pueden recomendarse en pacientes no respondedores, pacientes con cardiopatía isquémica o aquellos que reciben estimulación auricular para corregir unos parámetros de estimulación inapropiados18. Comentan que la estimulación únicamente desde VI no ha demostrado obtener mejores resultados clínicos que la estimulación biventricular en los estudios aleatorizados realizados35;36 y recogen el beneficio probable de evitar la estimulación apical18.
El documento de consenso de 2015 sobre la programación del DAI refiere que “puede ser razonable activar los algoritmos de ajuste automático de los intervalos de estimulación AV y VV para obtener un porcentaje elevado de latidos resincronizados y reducir la incidencia de eventos clínicos” con un nivel de indicación IIb37.
Longevidad de la batería
Para aumentar la longevidad de la batería pueden ser útiles la estimulación únicamente desde VI mediante la activación del algoritmos automático en los pacientes con intervalo AV normal, el control de captura de VI y VD así como el empleo de las herramientas de determinación automática de umbrales de estimulación y longevidad de batería en las múltiples configuraciones que ofrecen los electrodos cuatripolares que nos ayudan a seleccionar el vector de estimulación con mejores umbrales. Es también importante evitar choques inapropiados o innecesarios en pacientes con DAI-CRT mediante la programación de tiempos largos de detección, discriminadores de TSV, ruido eléctrico, onda T y ATP durante la carga. Por último debemos saber que se estima que la estimulación multipunto produce una disminución de la longevidad de la batería de entre 1 y 1,2 años de media.
Conclusiones
Ni la programación de los intervalos de estimulación por métodos ecocardiográficos o electrocardiográficos ni mediante los algoritmos automáticos de los dispositivos han demostrado de manera concluyente aumentar el porcentaje de pacientes que se benefician de la TRC. En casos individuales sí pueden resultar útiles la optimización por diferentes métodos de los intervalos de estimulación, la elección del sitio de estimulación en los electrodos cuatripolares, la estimulación multipunto de VI y los cambios de programación tras detecciones automáticas de estimulación ventricular izquierda inefectiva. Los pacientes que más se pueden beneficiar de estas estrategias son los no respondedores, los que reciben estimulación auricular o presentan ciertas características clínicas o electrocardiográficas como el bloqueo de rama derecha o la cardiopatía isquémica, en los que una programación empírica de los intervalos de estimulación puede ser subóptima con mayor frecuencia, y aquellos que han obtenido un mayor beneficio en los estudios randomizados realizados (antecedentes de FA o insuficiencia renal en el estudio Respond o intervalo AV “normal” en el ensayo Adaptive-CRT). Las estrategias destinadas a aumentar el porcentaje de respondedores continúan siendo un área de investigación actual.
Los resultados de los casos de estudio no son necesariamente predictivos de los resultados en otros casos. Los resultados de otros casos pueden variar. El contenido de este caso es responsabilidad únicamente del autor y no representa la opinión de Boston Scientific.
Bibliografía
(1) Mullens W, Grimm RA, Verga T, Dresing T, Starling RC, Wilkoff BL et al. Insights from a cardiac resynchronization optimization clinic as part of a heart failure disease management program. J Am Coll Cardiol 2009; 53(9):765-773.
(2) Porciani MC, Ricceri I, Attana P, Pennesi M, Michelotti F, Mascia G et al. Discordant electrical and mechanical atrial delays affect intracavitary electrogram-based cardiac resynchronization therapy optimization. Europace 2012; 14(4):593-598.
(3) Porciani MC, Dondina C, Macioce R, Demarchi G, Cappelli F, Lilli A et al. Temporal variation in optimal atrioventricular and interventricular delay during cardiac resynchronization therapy. J Card Fail 2006; 12(9):715-719.
(4) Bogaard MD, Kirkels JH, Hauer RN, Loh P, Doevendans PA, Meine M. Should we optimize cardiac resynchronization therapy during exercise? J Cardiovasc Electrophysiol 2010; 21(11):1307-1316.
(5) Mokrani B, Lafitte S, Deplagne A, Ploux S, Laborderie J, Reant P et al. Echocardiographic study of the optimal atrioventricular delay at rest and during exercise in recipients of cardiac resynchronization therapy systems. Heart Rhythm 2009; 6(7):972-977.
(6) Hernandez-Madrid A, Facchin D, Klepfer RN, Ghosh S, Matia R, Moreno J et al. Device pacing diagnostics overestimate effective cardiac resynchronization therapy pacing results of the hOLter for Efficacy analysis of CRT (OLE CRT) study. Heart Rhythm 2017.
(7) Rickards AF, Bombardini T, Corbucci G, Plicchi G. An implantable intracardiac accelerometer for monitoring myocardial contractility. The Multicenter PEA Study Group. Pacing Clin Electrophysiol 1996; 19(12 Pt 1):2066-2071.
(8) Delnoy PP, Marcelli E, Oudeluttikhuis H, Nicastia D, Renesto F, Cercenelli L et al. Validation of a peak endocardial acceleration-based algorithm to optimize cardiac resynchronization: early clinical results. Europace 2008; 10(7):801-808.
(9) Ritter P, Delnoy PP, Padeletti L, Lunati M, Naegele H, Borri-Brunetto A et al. A randomized pilot study of optimization of cardiac resynchronization therapy in sinus rhythm patients using a peak endocardial acceleration sensor vs. standard methods. Europace 2012; 14(9):1324-1333.
(10) Brugada J, Delnoy PP, Brachmann J, Reynolds D, Padeletti L, Noelker G et al. Contractility sensor-guided optimization of cardiac resynchronization therapy: results from the RESPOND-CRT trial. Eur Heart J 2016.
(11) Martin DO, Lemke B, Birnie D, Krum H, Lee KL, Aonuma K et al. Investigation of a novel algorithm for synchronized left-ventricular pacing and ambulatory optimization of cardiac resynchronization therapy: results of the adaptive CRT trial. Heart Rhythm 2012; 9(11):1807-1814.
(12) Birnie D, Lemke B, Aonuma K, Krum H, Lee KL, Gasparini M et al. Clinical outcomes with synchronized left ventricular pacing: analysis of the adaptive CRT trial. Heart Rhythm 2013; 10(9):1368-1374.
(13) Van Deursen CJ, Strik M, Rademakers LM, van HA, Kuiper M, Wecke L et al. Vectorcardiography as a tool for easy optimization of cardiac resynchronization therapy in canine left bundle branch block hearts. Circ Arrhythm Electrophysiol 2012; 5(3):544-552.
(14) Van Deursen CJ, Wecke L, van Everdingen WM, Stahlberg M, Janssen MH, Braunschweig F et al. Vectorcardiography for optimization of stimulation intervals in cardiac resynchronization therapy. J Cardiovasc Transl Res 2015; 8(2):128-137.
(15) Osca J, Alonso P, Cano O, Sanchez JM, Tejada D, Andres A et al. The use of quadripolar left ventricular leads improves the hemodynamic response to cardiac resynchronization therapy. Pacing Clin Electrophysiol 2015; 38(3):326-333.
(16) Cabrera BF, Alzueta RJ, Olague de RJ, Fernandez-Lozano I, Garcia Guerrero JJ, de la Concha JF et al. Improvement in hemodynamic response using a quadripolar LV lead. Pacing Clin Electrophysiol 2013; 36(8):963-969.
(17) Singh JP, Klein HU, Huang DT, Reek S, Kuniss M, Quesada A et al. Left ventricular lead position and clinical outcome in the multicenter automatic defibrillator implantation trial-cardiac resynchronization therapy (MADIT-CRT) trial. Circulation 2011; 123(11):1159-1166.
(18) Brignole M, Auricchio A, Baron-Esquivias G, Bordachar P, Boriani G, Breithardt OA et al. 2013 ESC guidelines on cardiac pacing and cardiac resynchronization therapy: the task force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). Europace 2013; 15(8):1070-1118.
(19) D’Onofrio A, Botto G, Mantica M, LA RC, Occhetta E, Verlato R et al. Incremental value of larger interventricular conduction time in improving cardiac resynchronization therapy outcome in patients with different QRS duration. J Cardiovasc Electrophysiol 2014; 25(5):500-506.
(20) Gold MR, Birgersdotter-Green U, Singh JP, Ellenbogen KA, Yu Y, Meyer TE et al. The relationship between ventricular electrical delay and left ventricular remodelling with cardiac resynchronization therapy. Eur Heart J 2011; 32(20):2516-2524.
(21) Polasek R, Kucera P, Nedbal P, Roubicek T, Belza T, Hanuliakova J et al. Local electrogram delay recorded from left ventricular lead at implant predicts response to cardiac resynchronization therapy: retrospective study with 1 year follow up. BMC Cardiovasc Disord 2012; 12:34.
(22) Zanon F, Baracca E, Pastore G, Fraccaro C, Roncon L, Aggio S et al. Determination of the longest intrapatient left ventricular electrical delay may predict acute hemodynamic improvement in patients after cardiac resynchronization therapy. Circ Arrhythm Electrophysiol 2014; 7(3):377-383.
(23) Biffi M, Foerster L, Eastman W, Eggen M, Grenz NA, Sommer J et al. Effect of bipolar electrode spacing on phrenic nerve stimulation and left ventricular pacing thresholds: an acute canine study. Circ Arrhythm Electrophysiol 2012; 5(4):815-820.
(24) Pappone C, Calovic Z, Vicedomini G, Cuko A, McSpadden LC, Ryu K et al. Multipoint left ventricular pacing in a single coronary sinus branch improves mid-term echocardiographic and clinical response to cardiac resynchronization therapy. J Cardiovasc Electrophysiol 2015; 26(1):58-63.
(25) Pappone C, Calovic Z, Vicedomini G, Cuko A, McSpadden LC, Ryu K et al. Improving cardiac resynchronization therapy response with multipoint left ventricular pacing: Twelve-month follow-up study. Heart Rhythm 2015; 12(6):1250-1258.
(26) Pappone C, Calovic Z, Vicedomini G, Cuko A, McSpadden LC, Ryu K et al. Multipoint left ventricular pacing improves acute hemodynamic response assessed with pressure-volume loops in cardiac resynchronization therapy patients. Heart Rhythm 2014; 11(3):394-401.
(27) Rinaldi CA, Kranig W, Leclercq C, Kacet S, Betts T, Bordachar P et al. Acute effects of multisite left ventricular pacing on mechanical dyssynchrony in patients receiving cardiac resynchronization therapy. J Card Fail 2013; 19(11):731-738.
(28) Thibault B, Dubuc M, Khairy P, Guerra PG, Macle L, Rivard L et al. Acute haemodynamic comparison of multisite and biventricular pacing with a quadripolar left ventricular lead. Europace 2013; 15(7):984-991.
(29) Osca J, Alonso P, Cano O, Andres A, Miro V, Tello MJ et al. The use of multisite left ventricular pacing via quadripolar lead improves acute haemodynamics and mechanical dyssynchrony assessed by radial strain speckle tracking: initial results. Europace 2015.
(30) Forleo GB, Santini L, Giammaria M, Potenza D, Curnis A, Calabrese V et al. Multipoint pacing via a quadripolar left-ventricular lead: preliminary results from the Italian registry on multipoint left-ventricular pacing in cardiac resynchronization therapy (IRON-MPP). Europace 2016.
(31) Daubert JC, Saxon L, Adamson PB, Auricchio A, Berger RD, Beshai JF et al. 2012 EHRA/HRS expert consensus statement on cardiac resynchronization therapy in heart failure: implant and follow-up recommendations and management. Heart Rhythm 2012; 9(9):1524-1576.
(32) Ghosh S, Stadler RW, Mittal S. Automated detection of effective left-ventricular pacing: going beyond percentage pacing counters. Europace 2015; 17(10):1555-1562.
(33) Matía R, Hernández-Madrid A, Faccin D, Nicholson-Klepfer R, Ghosh G, Moreno J, et al. A new EGM-based diagnostic algorithm to improve the left ventricular effective pacing detection corrected a non response to CRT pacing. Europace 2017 (In press).
(34) Auger D, Hoke U, Bax JJ, Boersma E, Delgado V. Effect of atrioventricular and ventriculoventricular delay optimization on clinical and echocardiographic outcomes of patients treated with cardiac resynchronization therapy: a meta-analysis. Am Heart J 2013; 166(1):20-29.
(35) Thibault B, Ducharme A, Harel F, White M, O’Meara E, Guertin MC et al. Left ventricular versus simultaneous biventricular pacing in patients with heart failure and a QRS complex >/=120 milliseconds. Circulation 2011; 124(25):2874-2881.
(36) Boriani G, Gardini B, Diemberger I, Bacchi Reggiani ML, Biffi M, Martignani C et al. Meta-analysis of randomized controlled trials evaluating left ventricular vs. biventricular pacing in heart failure: effect on all-cause mortality and hospitalizations. Eur J Heart Fail 2012; 14(6):652-660.
(37) Wilkoff BL, Fauchier L, Stiles MK, Morillo CA, Al-Khatib SM, Almendral J et al. 2015 HRS/EHRA/APHRS/SOLAECE expert consensus statement on optimal implantable cardioverter-defibrillator programming and testing. J Arrhythm 2016; 32(1):1-28.